专注于开发医疗疗法的生物技术公司 Vertex 与 CRISPR/Cas9 基因编辑技术发现者之一所拥有的 CRISPR Therapeutics 公司合作开发的全球首款用于治疗镰状细胞病的 CRISPR/Cas9 疗法 CASGEVY 已获得美国 FDA 批准。
镰状细胞病使患者因血细胞中的血红蛋白畸形而致残,导致贫血、血流问题、脾脏损伤等。目前的解决方案主要针对急性疼痛等短期症状(如亚马逊的这款产品)。这种疾病是由遗传自父母的 DNA 基因错误引起的,许多人在 45 岁之前就已死亡。
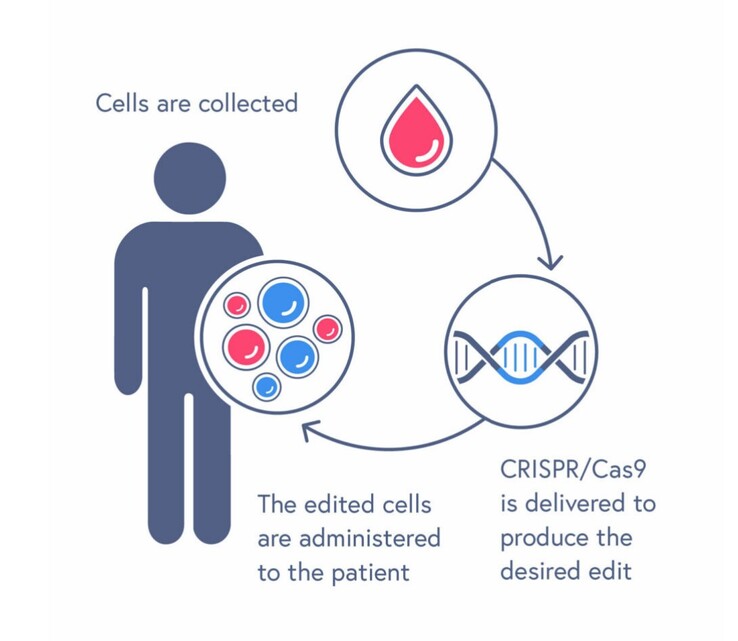
CRISPR/Cas9发明于2012年,是一项获得诺贝尔奖的基因编辑技术,可轻松定位、切割和编辑基因的特定区域。CASGEVY利用这一技术消除患者提取的造血干细胞中的错误,然后将这些细胞植入人体,从而治愈疾病。然而,CASGEVY并非没有风险。因为在移植前必须先用化疗杀死骨髓中所有坏血细胞,所以死亡和并发症很常见。
CASGEVY(exagamglogene autotemcel 或 exa-cel)是一种一次性治疗方法,适用于 12 岁以上的患者,可大大减轻或消除镰状细胞病。该疗法于 2023 年 11 月在巴林、英格兰、苏格兰和威尔士获批使用,2023 年 12 月在美国获批使用。
» Notebookcheck多媒体笔记本电脑Top 10排名
» Notebookcheck游戏笔记本电脑Top 10排名
» Notebookcheck低价办公/商务笔记本电脑Top 10排名
» Notebookcheck高端办公/商务笔记本电脑Top 10排名
» Notebookcheck工作站笔记本电脑Top 10排名
» Notebookcheck亚笔记本电脑Top 10排名
» Notebookcheck超级本产品Top 10排名
» Notebookcheck变形本产品Top 10排名
» Notebookcheck平板电脑Top 10排名
» Notebookcheck智能手机Top 10排名
» Notebookcheck评测过最出色的笔记本电脑屏幕
» Notebookcheck售价500欧元以下笔记本电脑Top 10排名
» Notebookcheck售价300欧元以下笔记本电脑Top 10排名
资料来源
2023 年 12 月 8 日
Vertex 和 CRISPR Therapeutics 宣布美国 FDA 批准 CASGEVY™(exagamloggene autotemcel)用于治疗镰状细胞病
- 美国首次批准基于 CRISPR 技术的基因编辑疗法--CASGEVY™(exagamglogene autotemcel)用于治疗镰状细胞病。
- 约 16,000 名 12 岁及以上的重症镰状细胞病患者现在有资格接受这种一次性治疗 - 多个授权治疗中心已启动
- 多个授权治疗中心启动
波士顿和瑞士楚格--(BUSINESS WIRE)--(美国商业资讯)--2023年12月8日--Vertex Pharmaceuticals Incorporated(纳斯达克股票代码:VRTX)和CRISPR Therapeutics(纳斯达克股票代码:CRSP)今天宣布,美国食品和药物管理局(FDA)已批准CRISPR Therapeutics在美国上市。CRISPR/Cas9基因组编辑细胞疗法 CASGEVY™(exagamloggene autotemcel [exa-cel])用于治疗 12 岁及以上反复发生血管闭塞性危象(VOCs)的镰状细胞病(SCD)患者。此次获批意味着,约 16,000 名 SCD 患者首次有资格接受一次性持久疗法,通过消除严重 VOC 和因严重 VOC 导致的住院治疗,有可能实现疾病的功能性治愈。
"Vertex公司首席执行官兼总裁、医学博士Reshma Kewalramani表示:"CASGEVY获得FDA批准意义重大:这是美国批准的首个基于CRISPR的基因编辑疗法。"我想向患者和研究人员表达我最深切的谢意,他们对这项计划的信任为这一里程碑式的批准铺平了道路。
"公司成立之初,我们就有将 CRISPR 技术转化为多种突破性疗法的愿景。CRISPR Therapeutics 公司董事长兼首席执行官 Samarth Kulkarni 博士说:"因此,美国批准首例使用 CRISPR 基因编辑技术的药物令人叹为观止,这对我个人和整个公司来说都是一个真正令人谦卑的时刻。
"费城儿童医院细胞治疗与移植科科长、凯利癌症免疫治疗中心主任、CLIMB-121 临床项目指导委员会主席 Stephan Grupp 博士说:"能够参与这项开创性的项目,我感到非常荣幸。"CASGEVY有可能成为患者的一种变革性治疗方法,我期待着继续开展工作,确保全国各地符合条件的患者都能获得这种疗法"。
CASGEVY的治疗需要干细胞移植方面的专业经验;因此,Vertex正与经验丰富的医院合作,在全美建立一个独立运营的授权治疗中心(ATC)网络,为患者提供CASGEVY治疗。以下 ATC 已经启动:
马萨诸塞州波士顿的波士顿医疗中心
华盛顿特区国家儿童医院
加州洛杉矶希望之城儿童癌症中心
得克萨斯州达拉斯医疗城儿童医院
德克萨斯州圣安东尼奥卫理公会儿童医院
俄亥俄州哥伦布市全国儿童医院
田纳西州纳什维尔 TriStar Centennial 儿童医院
俄亥俄州立大学综合癌症中心--位于俄亥俄州哥伦布市的詹姆斯癌症医院和索洛维研究所
伊利诺伊州芝加哥市的芝加哥大学/柯默儿童医院。
未来几周内还将启用更多的ATC,完整的ATC名单,包括批准后的更新,可在CASGEVY.com网站上查阅。
关于 CASGEVY™(exagamglogene autotemcel [exa-cel])
CASGEVY是一种基因组编辑细胞疗法,由自体CD34+造血干细胞(HSCs)组成,通过CRISPR/Cas9技术编辑BCL11A基因的红细胞特异性增强子区域。CASGEVY 用于通过造血干细胞移植手术一次性给药,患者自身的 CD34+ 细胞经过修饰后可减少 BCL11A 在红系细胞中的表达,从而增加胎儿血红蛋白(HbF)的生成。HbF是胎儿发育过程中自然存在的携氧血红蛋白形式,出生后转为成人血红蛋白形式。CASGEVY 已被证明可以减少或消除 SCD 患者的血管闭塞性危象。
CASGEVY 已获得英国药品与保健品监管局(UK Medicines and Healthcare products Regulatory Agency)和巴林国家卫生监管局(National Health Regulatory Authority in Bahrain)的有条件上市许可,用于治疗 12 岁及以上以反复出现血管闭塞性危象或输血依赖性β地中海贫血(TDT)为特征、适合进行造血干细胞移植且无法获得人类白细胞抗原匹配的相关造血干细胞供体的 SCD 患者。目前,欧洲药品管理局和沙特食品药品管理局正在对 CASGEVY 用于 SCD 和 TDT 进行审查。
在美国,CASGEVY 用于治疗 TDT 仍处于研究阶段。Vertex公司已向美国FDA提交了一份BLA,申请将CASGEVY用于12岁及以上TDT患者的治疗,并被指定于2024年3月30日通过《处方药使用者付费法案》(PDUFA)。
关于 Vertex/CRISPR 合作财务报告
在 CRISPR Therapeutics 的支持下,Vertex 负责 CASGEVY 的全球开发、生产和商业化。在 CASGEVY 获得 FDA 批准的同时,Vertex 将向 CRISPR 支付 2 亿美元的里程碑款项,这笔款项将被资本化并摊入销售成本。此外,Vertex 将记录 CASGEVY 100% 的收入、销售成本以及销售、总务和管理费用,并将 CRISPR 在 CASGEVY 净利润或亏损中所占的 40% 份额记录在销售成本中。最后,Vertex 将记录 60% 的研发费用,扣除 CRISPR 40% 的份额。
关于镰状细胞病
镰状细胞病(SCD)是一种使人衰弱、进展性和缩短寿命的疾病。SCD 患者的健康相关生活质量评分远低于普通人群,在美国,复发性 VOC 患者终生管理 SCD 的医疗费用估计在 400 万到 600 万美元之间。SCD 是一种遗传性血液疾病,会影响红细胞,而红细胞是将氧气输送到身体所有器官和组织的重要物质。由于红细胞畸形或 "镰状",SCD 会导致剧烈疼痛、器官损伤和寿命缩短。SCD 的临床特征是 VOCs,它是由病变的红细胞堵塞血管引起的,会导致全身任何部位随时随地都可能发生的剧烈疼痛。SCD 需要终生治疗,并导致预期寿命缩短。在美国,SCD 患者的中位死亡年龄约为 45 岁。目前,治愈 SCD 的方法是进行配型捐献者的干细胞移植,但由于缺乏可用的捐献者,只有一小部分 SCD 患者可以选择这种方法。
帮助患者踏上 CASGEVY 之旅
Vertex Connects™ 是一项针对美国符合条件的 CASGEVY 患者的计划。通过 Vertex Connects,护理经理可提供教育资源、沟通和支持,帮助患者顺利完成治疗,符合条件的患者还可获得额外的帮助。
有关ATC、CASGEVY治疗过程和Vertex Connects的更多信息,请致电1-833-VERTEX-5 (1-833-837-8395) - 并在VertexConnects.com上了解有关我们患者支持计划的更多信息。
CASGEVY (exagamglogene autotemcel)的美国适应症和重要安全信息
CASGEVY 是一种一次性疗法,用于治疗 12 岁及以上频繁发生血管闭塞性危象或 VOC 的镰状细胞病 (SCD) 患者。
CASGEVY 使用患者自身编辑的造血干细胞,专为每位患者制造,可增加一种名为血红蛋白 F(胎儿血红蛋白或 HbF)的特殊血红蛋白的生成。HbF越多,血红蛋白的总体水平就越高,并能改善红细胞的生成和功能。这可以消除 SCD 患者体内的 VOC。
重要安全信息
关于 CASGEVY,我应该知道的最重要的信息是什么?
接受 CASGEVY 治疗后,在 CASGEVY 进入您的骨髓之前,您的血细胞数量会暂时减少。这包括血小板(通常用于帮助血液凝固的细胞)和白细胞(通常用于抵抗感染的细胞)水平较低。医生会对此进行监测,并根据需要给予治疗。当血细胞水平恢复到安全水平时,医生会告诉您。
如果您出现以下情况,请立即告诉您的医疗服务提供者,这可能是血小板细胞水平过低的迹象:
剧烈头痛
异常瘀伤
长时间出血
无外伤出血,如流鼻血;牙龈出血;尿血、便血或呕血;或咳血
如果出现以下情况,请立即告知您的医疗服务提供者,这可能是白细胞水平低的征兆:
发烧
发冷
感染
您可能会出现与 CASGEVY 治疗方案中的其他药物相关的副作用。请向您的医生咨询这些可能的副作用。您的医疗服务提供者可能会给您提供其他药物来治疗您的副作用。
我将如何接受 CASGEVY?
作为 CASGEVY 治疗的一部分,您的医疗服务提供者将为您提供其他药物,包括调节药物。请务必向您的医疗服务提供者了解治疗过程中所有药物的风险和益处。
接受调理药物治疗后,您可能无法怀孕或生育。您应在治疗前与医疗服务提供者讨论保留生育能力的方案。
第1步:在CASGEVY治疗前,医生会给你注射动员药物。这种药物会将骨髓中的造血干细胞转移到血液中。然后,造血干细胞会被收集到一台分离不同血细胞的机器中(这被称为 "无细胞抽吸术")。整个过程可能不止进行一次。每次可能需要一周时间。
在这一步骤中,医院还会收集和储存挽救细胞。这些细胞是您现有的造血干细胞,未经处理,以防治疗过程中出现问题。如果 CASGEVY 不能在调理药物后使用,或者如果改造后的造血干细胞不能在体内存活(移植),这些救援细胞将被回输给您。如果您获得了救援细胞,您将不会从 CASGEVY 中获得任何治疗益处。
第二步:采集后,您的造血干细胞将被送往生产基地,用于制造 CASGEVY。从采集您的细胞到生产和测试 CASGEVY,可能需要长达 6 个月的时间,然后才会将 CASGEVY 送回您的医疗机构。
第3步:在干细胞移植前不久,您的医疗服务提供者将在医院为您提供几天的调理药物。这将通过清除骨髓中的细胞为治疗做好准备,以便用 CASGEVY 中的改良细胞取代。服药后,您的血细胞水平将降至非常低的水平。这一步您将留在医院,直到输完 CASGEVY。
第 4 步: 一瓶或多瓶 CASGEVY 将在短时间内注入静脉(静脉注射)。
输注 CASGEVY 后,您将留院观察,以便医护人员密切监测您的恢复情况。这可能需要 4-6 周的时间,但时间可能会有所不同。医护人员将决定您何时可以回家。
接受 CASGEVY 后应避免什么?
今后任何时候都不要捐献血液、器官、组织或细胞。
CASGEVY 可能或有可能产生哪些副作用?
CASGEVY 最常见的副作用包括
血小板水平低,这可能会降低血液凝固的能力,并可能导致出血
白细胞水平低,可能使您更容易受到感染
您的医疗服务提供者将检测您的血液,以检查血细胞(包括血小板和白细胞)水平是否偏低。如果出现以下任何症状,请立即告知您的医疗服务提供者:
发烧
发冷
感染
剧烈头痛
异常瘀伤
长期出血
无伤出血,如流鼻血;牙龈出血;尿血、便血或呕血;或咳血
这些并非 CASGEVY 可能产生的所有副作用。有关副作用,请致电医生咨询。您可以拨打 1-800-FDA-1088 向 FDA 报告副作用。
安全有效使用 CASGEVY 的一般信息
请向您的医护人员咨询任何健康问题。
请参阅 CASGEVY 的完整处方信息,包括患者信息。
关于Vertex
Vertex 是一家全球性生物技术公司,投资于科学创新,为严重疾病患者创造变革性药物。公司已经批准了治疗多种慢性、缩短生命的遗传性疾病--囊性纤维化、镰状细胞病和输血依赖性β地中海贫血--根本原因的药物,并将继续推进这些疾病的临床和研究项目。此外,Vertex 公司还在其他严重疾病领域拥有一系列临床研究疗法,包括 APOL1 介导的肾脏疾病、急性和神经性疼痛、1 型糖尿病和α-1 抗胰蛋白酶缺乏症。
Vertex 公司成立于 1989 年,全球总部设在波士顿,国际总部设在伦敦。此外,公司还在北美、欧洲、澳大利亚和拉丁美洲设有研发基地和商务办事处。恆進系統一直被公認為業界最佳工作場所之一,包括連續14年入選《科學》雜誌的最佳雇主名單,以及《財富》雜誌的100家最佳工作公司之一。欲了解公司最新信息和Vertex的创新历史,请访问 www.vrtx.com 或在LinkedIn、Facebook、Instagram、YouTube和Twitter/X上关注我们。
关于 CRISPR Therapeutics
CRISPR Therapeutics 是一家领先的基因编辑公司,致力于利用其专有的 CRISPR/Cas9 平台开发治疗严重疾病的基因药物。CRISPR/Cas9 是一种革命性的基因编辑技术,可以对基因组 DNA 进行精确、定向的改变。CRISPR Therapeutics 公司已在血红蛋白病、肿瘤、再生医学和罕见病等多个疾病领域建立了治疗项目组合。为了加速和扩大其努力,CRISPR Therapeutics 公司与拜耳公司、Vertex 制药公司和 ViaCyte 公司等领先公司建立了战略合作关系。CRISPR Therapeutics AG 总部位于瑞士楚格,在美国拥有全资子公司 CRISPR Therapeutics, Inc.,在马萨诸塞州波士顿和加利福尼亚州旧金山设有研发机构,在英国伦敦设有业务办事处。欲了解更多信息,请访问 www.crisprtx.com。
CRISPR THERAPEUTICS® 文字商标和设计是 CRISPR Therapeutics AG 的商标和注册商标。所有其他商标和注册商标均为其各自所有者的财产。
Vertex 关于前瞻性声明的特别说明
本新闻稿包含1995年《私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)修订版定义的前瞻性声明,包括但不限于医学博士Reshma Kewalramani、医学博士Samarth Kulkarni和医学博士Stephan Grupp的声明,以及有关CASGEVY在美国的预期合格患者人群的声明、Vertex公司计划向CRISPR公司支付里程碑付款,以及Vertex公司对与CASGEVY相关的里程碑付款、预期收入、销售成本、费用和净利润或亏损的预期会计处理。尽管Vertex公司认为本新闻稿中包含的前瞻性表述是准确的,但这些前瞻性表述仅代表公司截至本新闻稿发布之日的观点,存在一些风险和不确定性,可能导致实际事件或结果与这些前瞻性表述明示或暗示的结果存在实质性差异。这些风险和不确定因素包括:由于安全性、有效性或其他原因,公司开发项目的数据可能不支持其化合物的注册或进一步开发;CASGEVY在欧洲和沙特阿拉伯王国获得批准和商业化可能无法按预期时间表进行,或根本无法进行;以及Vertex公司最近向美国证券交易委员会提交的年度报告和后续文件(www.sec.gov)中 "风险因素 "标题下列出的其他风险,这些文件可通过公司网站www.vrtx.com。閣下不應過度依賴這些聲明或所提供的科學數據。Vertex公司不承担在有新信息时更新本新闻稿中信息的义务。
CRISPR Therapeutics 前瞻性声明
本新闻稿可能包含《1995年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)(经修订)所界定的若干 "前瞻性声明",包括医学博士Reshma Kewalramani、医学博士Samarth Kulkarni和医学博士Stephan Grupp在本新闻稿中的声明,以及医学博士Reshma Kewalramani和医学博士Samarth Kulkarni在本新闻稿中的声明、以及有关 CRISPR Therapeutics 的声明:(i) CASGEVY 商业化的计划和预期,以及 CASGEVY 的预期收益,包括在美国符合 CASGEVY 治疗条件的预期患者人群和患者获得 CASGEVY 的情况;(ii) 对正在进行的 exa-cel 临床试验的预期,包括临床数据对患者的潜在影响;(iii) 对其他监管机构决定的时间表和预期;(iv) 从 Vertex 收到里程碑付款;以及 (v) 对 CRISPR/Cas9 基因编辑技术和疗法的治疗价值、发展和商业潜力的预期。在不限制前述内容的前提下,"相信"、"预计"、"计划"、"期望 "及类似表述旨在识别前瞻性声明。请注意,前瞻性声明本身具有不确定性。尽管CRISPR Therapeutics认为此类声明是基于对其业务和运营的合理假设,但现有投资者和潜在投资者应注意,前瞻性声明本身具有不确定性,既不是承诺也不是保证,不要过分依赖此类声明,因为此类声明仅代表作出声明当日的情况。由于存在各种风险和不确定性,实际业绩和结果可能与前瞻性陈述中预测或暗示的业绩和结果存在实质性差异。这些风险和不确定因素包括正在进行的 exa-cel 临床试验的临床数据不会在正在进行的或计划进行的临床试验中继续或重复,或者可能无法支持监管部门的批准或有条件授权的延期;其他司法管辖区的监管部门可能无法按照预期的时间表或根本无法获得批准;在监管部门批准后,可能无法获得足够的定价或报销来支持 exa-cel 的继续开发或商业化;未来的竞争或其他市场因素可能会对 CASGEVY 的商业潜力产生不利影响;CRISPR Therapeutics 可能无法实现与 Vertex 合作的潜在利益;CRISPR Therapeutics 的技术和属于第三方的知识产权的知识产权保护存在不确定性;CRISPR Therapeutics 最新的 10-K 表年报、10-Q 表季报以及 CRISPR Therapeutics 随后向美国证券交易委员会提交的任何其他文件中 "风险因素 "标题下描述的风险和不确定性。美国证券交易委员会网站 www.sec.gov。除法律要求外,CRISPR Therapeutics不承担更新或修改本新闻稿中任何前瞻性声明的义务或承诺。
查看businesswire.com上的源版本:https://www.businesswire.com/news/home/20231208951733/en/
顶点制药公司
投资者:
或
Manisha Pai, +1 617-961-1899
媒体
或
国际+44 20 3204 5275
或
美国: 617-341-6992
或
Heather Nichols: +1 617-839-3607
CRISPR Therapeutics
投资者:
Susan Kim, +1 617-307-7503
媒体:Rachel Eides, +1-617-315-4493
Rachel Eides, +1-617-315-4493
资料来源顶点制药公司